Banyak penelitian dilakukan untuk mengidentifikasi perubahan biokimiawi dalam sel kanker atau sel yang mengalami transformasi dan membedakannya dengan sel normal. Tetapi ternyata penelitian-penelitian itu tidak mampu membedakan perubahan biokimiawi yang menyebabkan transformasi (primer) dari perubahan biokimiawi sebagai akibat transformasi atau sebagai konsekuensi sekunder terjadinya transformasi.
Sel kanker biasanya mengandung jumlah kromosom atau rearrangements kromosom yang abnormal (aneuploidi), yang menunjukkan instabilitas genetik yang berperan penting pada tumorigenesis. Selain itu, sel kanker seringkali berbeda dari sel normal dalam beberapa sifat biokimiawi, termasuk di antaranya peningkatan glikolisis, sekresi faktor pertumbuhan, sekresi protease, penurunan ekspresi protein permukaan yang diperlukan untuk adhesi, dan disorganisasi sitoskeleton.
Seperti telah dikemukakan sebelumnya, beberapa di antara perubahan ini secara langsung berkaitan dengan kelainan sifat pertumbuhan sel yang mengalami transformasi. Misalnya ekskresi faktor pertumbuhan mengurangi kebutuhan sel kanker akan faktor pertumbuhan eksogen, penurunan ekspresi molekul adhesi menyebabkan hilangnya contact inhibition, dan perubahan struktur sitoskeleton menyebabkan morfologi sel ganas berbeda dengan sel normal.
Walaupun demikian tidak ada satupun penanda fenotip ganas di atas unik untuk sel yang mengalami transformasi, demikian pula tidak jelas apakah perubahan-perubahan itu penyebab atau akibat transformasi. Karena itu untuk lebih memahami sifat-sifat sel kanker perhatian diarahkan untuk mempelajari gen-gen spesifik yang diduga menginduksi transformasi.
REGULATOR PERTUMBUHAN SEL
Seperti telah disebut di atas, sel secara terus menerus dihadapkan pada pengambilan keputusan untuk membelah, diferensiasi atau menjalani proses apoptosis. Ketiganya memberi dampak pada jumlah sel sehingga jalur di mana proses pembelahan, diferensiasi dan apoptosis berlangsung merupakan sasaran aktivitas onkogen dan tumor suppressor genes.Golongan gen lain yang juga merupakan sasaran aktivitas onkogenik adalah gen-gen yang berfungsi dalam perbaikan DNA.
Onkogen dan tumor suppressor gene (TSG)
Sebagian besar onkogen dan tumor suppressor gene (TSG) beraksi melalui intervensi langsung pengaturan siklus sel normal. Mutasi proto-onkogen yang menghasilkan amplifikasi dan peningkatan fungsi onkogen (gain of function mutation) mengakibatkan onkogen terus menerus mengaktifkan komponen-komponen lain dalam kaskade transduksi sinyal termasuk faktor transkripsi yang kemudian menghasilkan pembelahan sel.
Di lain fihak mutasi pada TSG yang menyebabkan inaktivasi (loss of function mutation) akan berkibat hilangnya rem pengatur laju pertumbuhan. Beberapa jenis onkogen secara langsung membatalkan aktivitas protektif TSG dan sebaliknya beberapa jenis TSG dapat mendeteksi adanya onkogen dan berusaha melawannya. Kedua kelompok gen ini berinteraksi melalui suatu jejaring pengaturan sinyal pertumbuhan.
Di antara onkogen penting yang berfungsi dalam proses di atas adalah onkogen Ras dan cyclin/cdk Onkogen Ras memegang peranan penting dalam transmisi sinyal ekstraseluler ke dalam sel. Untuk fungsinya ini Ras menggunakan beberapa jalur efektor yang melawan aktivitas berbagai gen supresor (TSG), yaitu jalur Ras-Raf dan jalur Ras-PI3K. Kaskade jalur Ras-Raf-Erk merupakan jalur utama yang bertanggung jawab atas transmisi sinyal proliferasi dari membran sel ke nukleus.
Diduga aktivasi Ras-Raf-Erk ini mengakibatkan peningkatan transkripsi gen MDM2 yang fungsinya menurunkan stabilitas (destabilisasi) gen p53. Peningkatan transkripsi MDM2 menekan aktivitas p53. Selain menekan aktivitas p53, jalur Ras-Raf juga menekan aktivitas gen NF1 yang terlibat dalam perkembangan neurofibromatosis. Dengan menekan fungsi TSG, jalur Ras-Raf-Erk dapat meneruskan sinyal proliferasi kepada gen-gen dalam nukleus yang relevan. pada jalur Ras-PI3K, Ras mengaktifkan phosphatidyl-inositol 3’kinase (PI3K).
Aktivitas PI3K dilawan oleh fosfatase dan keseimbangan antara kedua aktivitas menentukan jumlah fosfatidil-inositol trifosfat pada membran sel. Di antara protein yang diaktifkan dengan cara berikatan dengan fosfatidil- inositol trifosfat adalah serine/threonine kinase Akt. Protein Akt berfungsi melaksanakan proses peningkatan ketahanan hidup yang dipromosikan oleh PI3K.
Beberapa jenis tumor suppressor gene TSG diprogramkan untuk mendeteksi dan berespons terhadap sinyal yang diberikan oleh onkogen, jadi berfungsi sebagai pertahanan terhadap aktivitas onkogen. Beberapa di antaranya adalah p53, BRCA1/BRCA2, NK4a dan ARF. ARF dapat mengikat MDM2 dan menghambat fungsinya; dengan demikian ia menstabilkan p53. ARF dan INK4a diekspresikan sebagai respons terhadap onkogen Ras dan Myc; dengan demikian ia memberi sinyal kepada gen p53 tentang keberadaan onkogen bersangkutan.
Tetapi fungsi gen p53 tidak hanya semata-mata melindungi sel terhadap onkogen; ia juga melindungi sel terhadap kerusakan DNA permanen dengan mendeteksinya dan memberi sinyal kepada gen DNA repair.
Kehilangan atau inaktivasi gen p53 akan berakibat instabilitas genetik. Jumlah protein p53 bertambah sebagai respons terhadap berbagai sinyal, misalnya sinyal kerusakan DNA, terhentinya sintesis DNA atau RNA atau bila tidak tersedia nukleotida (depletion). Rangsangan yang sama juga mengaktifkan p53 tanpa adanya stress, yang biasanya laten.
Peningkatan kecepatan awal translasi mRNA p53 dapat juga mengganggu kestabilan p53. Protein p53 dapat mengalami degradasi melalui berbagai cara, salah satu di antaranya adalah melalui pengikatan dengan protein Mdm2. Gen p53 mutan memiliki half life yang lebih panjang dan produknya tidak mampu meningkatkan ekspresi protein Mdm2 dengan akibat tidak terjadinya degradasi protein p53.
Banyak jalur melalui mana sinyal-sinyal ditangkap oleh p53, di antaranya jalur DNA-dependent protein kinase (DNAPK) yang berfungsi meng-fosforilasi p53, jalur MAP-kinase yang memodulasi p53 dan lain-lain.
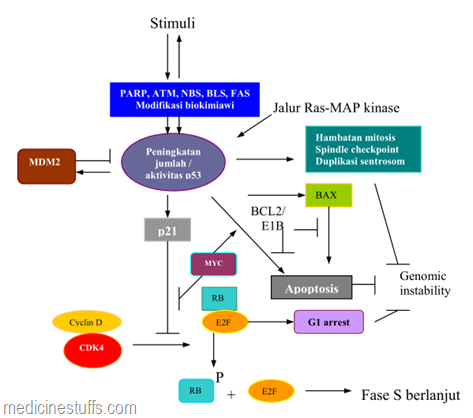
P53 berakumulasi dan dimodifikasi serta diaktivasi sebagai respons terhadap sinyal-sinyal yang dihasilkan oleh berbagai stres genotoksik. Beberapa protein, termasuk ATM, PARP (poly-ADP-ribose polimerase), FAS, BLS (Bloom’s syndrome) dan NBS (Nymegen breakage syndrome) terlibat dalam aktivasi. Jalur RAS-MAP kinase terlibat dalam menentukan kadar basal p53 dan dapat mempengaruhi fungsinya.
Beberapa fungsi sel yang dipengaruhi oleh p53 dapat ditekan oleh ekspresi yang tidak terkontrol dari Myc, Bcl2, E1B atau E2F. Kontrol aktivitas p53 mencakup lingkaran autoregulasi yang melibatkan Mdm2. Perangkat lengkap jalur p53 membantu memelihara integritas genom dengan menyingkirkan sel-sel yang rusak, baik dengan menginduksi G1 arrest untuk memperbaiki DNA atau menginduksi apoptosis. Gen p53 juga membantu mengatur masuknya siklus el ke dalam fase mitosis, pembentukan spindle dan integritas sentrosom, yaitu checkpoints siklus sel yang terlibat dalam mencegah kerusakan DNA.
Salah satu jalur yang digunakan oleh p53 untuk menginduksi G1-arrest adalah melalui p21 yang akan melawan aktivitas kompleks cyclin-CDK. Karena itu inaktivasi p21 maupun ekspresi berlebihan cyclin, misalnya cyclin D1 , akan mengakibatkan salah satu jalur regulasi p53 terganggu, dan hal ini sering dijumpai pada berbagai jenis kanker di antaranya kanker kolorektal. Inaktivasi p21 dan atau amplifikasi cyclin berkaitan erat dengan prognosis dan survival.
Seperti telah diuraikan di atas, mutasi gen p53 dijumpai pada banyak jenis kanker, misalnya pada 75-80% kanker kolon. Individu yang memiliki kerentanan terhadap predisposisi kanker seperti yang terlihat pada sindrom Li-Fraumeni, dilahirkan dengan mewarisi mutasi pada satu alel gen p53 dan dapat menderita kanker dengan mutasi p53 pada kedua alel, walaupun ada juga yang mutasinya terjadi hanya pada satu alel (disebut dominan negatif). Hal ini disebabkan alel p53 yang mutan mengganggu fungsi alel yang normal (wild type). Mutasi p53 seperti telah disebut di atas mengakibatkan instabilitas genetik dan memudahkan terjadinya mutasi gen lain.
Gen BRCA1/BRCA2 adalah tumor suppresor gene yang terdapat dalam berbagai jenis sel dan dikaitkan dengan proliferasi dan diferensiasi sel-sel jaringan yang berasal dari ektoderm dan mesoderm. Dalam jaringan payudara, BRCA1/BRCA2 diekspresikan pada sel epitel alveolar dan duktal. Mutasi BRCA1 dan atau BRCA2 dalam germline cells bertanggung jawab atas sebagian besar kanker payudara herediter.
Protein BRCA1 terletak pada kompartemen nukleus semua sel. Walaupun demikian, distribusinya dalam nukleus bervariasi sesuai siklus sel; ia berkelompok dalam nukleus selama fase S dan G2 dan tersebar merata dalam nukleoplasma pada fase G1.
Lebih dari 200 jenis germline mutations BRCA1 dan lebih dari 80 jenis mutasi BRCA2 telah diidentifikasi yang dapat dijumpai pada keluarga dengan kanker payudara herediter, tetapi peranannya pada kanker payudara sporadis belum diketahui. Walaupun aktivitas biologiknya belum diketahui pasti, bukti-bukti penelitian terakhir mengungkapkan gen tersebut sebagai genome caretakers yang berfungsi memelihara integritas genom.
Tumor suppressor gene lain yang mempunyai peranan penting dalam mengatur pertumbuhan sel adalah gen retinoblastoma (Rb). Seperti telah disebut di atas protein yang secara langsung mengatur atau diatur oleh cyclin-cdk merupakan sasaran lesi pada kanker. Gen Rb adalah salah satu yang telah dipelajari secara intensif di samping gen p53. Gen ini untuk pertama kali dijumpai pada kanker retinoblastoma herediter. Mutasi Rb tidak terbatas pada retinoblastoma tetapi diumpai pada banyak jenis kanker lain. Kelainan fungsi gen Rb disebabkan deletion pada kromosom 13 q14.
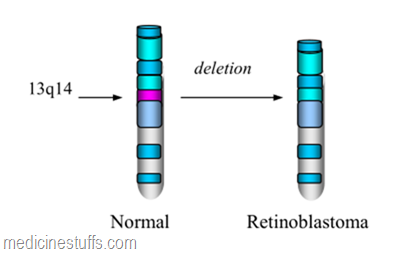
Seperti tampak pada gambar di atas, kehilangan region pada kromosom 13q14 mengakibat kan mutasi / inaktivasi gen Rb. Protein yang disandi oleh gen Rb, yaitu p105-Rb, diekspresikan dalam nukleus dalam bentuk hiperfosforilasi atau tidak terfosforilasi. Protein p105-Rb yang tidak terfosforilasi terdapat pada sel yang tidak membelah (istirahat) sedangkan yang terfosforilasi terdapat pada sel yang sedang berproliferasi pada fase G1 akhir, sebelum memasuki fase S.
Fosforilasi dan defosforilasi Rb diatur oleh berbagai cyclin, khususnya cyclin-D. Selama fase G1 dari siklus sel, E2F terikat pada p105-Rb yang tidak terfosforilasi tetapi kemudian dilepaskan melalui fosforilasi pada batas fase G1/S. Setelah dilepaskan, E2F mengaktifkan faktor transkripsi yang menjadi sasarannya, di antaranya berbagai enzim yang terlibat dalam sintesis DNA. Kehilangan fungsi atau mutasi Rb, atau adanya DNA virus tumor yang mengikat Rb, menyebabkan gangguan pada proses fosforilasi/defosforilasi Rb yang mengakibatkan gangguan kontrol pertumbuhan.
Telomere dan telomerase
Seperti telah diuraikan di atas, stabilitas genetik merupakan prasyarat untuk pertumbuhan sel normal, sebaliknya instabilitas genetik merupakan salah satu sifat sel kanker yang paling jelas dan banyak sifat sel kanker didasarkan atas instabilitas genetik ini. Stabilitas genetik dapat terganggu melalui berbagai cara, misalnya kegagalan mismatch repair, segregasi kromosom yang tidak tepat, rearrangement kromosom dan kehilangan telomere.
Telomere adalah suatu kompleks antara DNA dengan protein yang menutup dan melindungi ujung-ujung kromosom, sedangkan telomerase adalah enzim protein-RNA yang memperpanjang telomere setiap kali terjadi pembelahan sel. Pada manusia, sel-sel embrio terbukti mengekspresikan telomerase tetapi pada orang dewasa hanya sedikit sel yang memiliki aktivitas telomerase.
Dengan terbatasnya kandungan telomerase, telomere secara bertahap menjadi lebih pendek sejalan dengan bertambahnya umur sel. Erosi ujung kromosom akan membatasi jumlah pembelahan sel. Pada sel kanker, terjadi aktivasi abnormal telomerase yang menyebabkan sel membelah terus. Dengan demikian sinyal untuk menghentikan pertumbuhan diabaikan (by pass) pada tumorigenesis.
Kenyataan ini menimbulkan pemikiran ke arah menghambat aktivitas telomerase sebagai salah satu alternatif terapi. Telomerase di anggap sebagai penanda ganas baru yang merupakan indikator prognosis dan sasaran terapi pada kanker. Setiap kali sel membelah, selalu ada kehilangan 50-100 pasangan basa pada ujung telomer. Hal ini merupakan konsekuensi polaritas untaian DNA dan mekanisme replikasi DNA.
Bila telomere kehilangan sejumlah pasangan basa ia memberikan rangsangan kepada sel untuk menghentikan pembelahan sel. Kehilangan telomere diatasi oleh sel dengan mengaktifkan telomerase yang menambah sekuen telomere untuk mengganti sekuen yang hilang.
Aktivasi telomerase mencegah pemendekan kromosom dan penuaan dengan konsekuensi proliferasi terjadi terus menerus. Struktur telomere di ujung kromosom memendek akibat replikasi DNA. Bila panjang telomere mencapai titik kritis, sebagian besar sel keluar dari siklus sel dan berhenti berproliferasi. Enzim telomerase akan menambah asam- asam amino yang diperlukan untuk membentuk telomere sehingga menambah kemampuan sel untuk membelah.
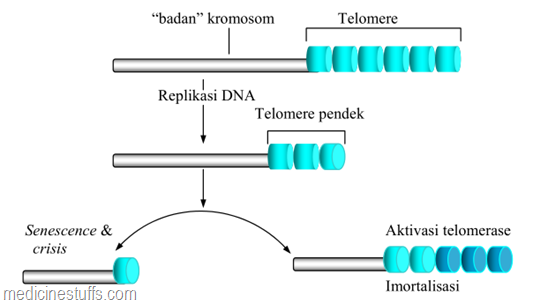
Proses ini berlangsung seimbang, mencegah kromosom memendek selama pembelahan sel dan mencegah sel untuk menerima sinyal penghentian pembelahan sel. Sel yang memproduksi telomerase di antaranya adalah stem-cell dan sel kanker, sedangkan sel somatik normal tidak memiliki aktivitas telomerase.
Stem cell mengurangi produksi telomerase secara bertahap sesuai dengan penuaan sel; kadar telomerase dalam stem cell hanya cukup untuk mencegah kehabisan telomere dalam jaringan yang perlu memperbaharui diri secara cepat.
Apoptosis
Seperti telah disebut di atas salah satu proses yang memberi dampak pada jumlah sel dalam jaringan termasuk jaringan tumor adalah apoptosis. Apoptosis adalah kematian sel terprogram yang merupakan proses penting dalam pengaturan homeostasis normal.
Proses ini menghasilkan keseimbangan dalam jumlah sel jaringan tertentu melalui eliminasi sel yang rusak dan proliferasi fisiologis dan dengan demikian memelihara agar fungsi jaringan normal. Deregulasi apoptosis mengakibatkan keadaan patologis, termasuk proliferasi sel secara tidak terkontrol seperti dijumpai pada kanker.
Ada berbagai bukti yang menyatakan kontrol apoptosis dikaitkan dengan gen yang mengatur berlangsungnya siklus sel, di antaranya gen p53, Rb, Myc, E1A dan keluarga Bcl2. Gangguan regulasi proliferasi sel baik akibat aktivitas onkogen dominan maupun inaktivasi tumor suppressor genes ada hubungannya dengan kontrol apoptosis.
Beberapa jenis virus onkologik melaksanakan proses transformasi sel dengan cara mengganggu fungsi apoptosis dalam sel. misalnya SV40, herpes dan adenovirus, polioma maupun virus Epstein Barr (EBV). Keluarga gen Bcl2 dan produknya diidentifikasi sebagai regulator kunci dalam proses apoptosis dalam banyak jenis sel. Keluarga protein ini dikelompokkan dalam 2 kelompok yaitu kelompok apoptotik dan anti-apoptotik yang berbeda dalam fungsi tetapi mempunyai struktur yang homolog.
Yang termasuk kelompok apoptotik adalah Bax, Bak, Bcl-X S , Bad, Bik dan Bid, sedangkan yang termasuk golongan anti-apoptotik adalah Bcl2, Bcl-X L , Mcl- 1. 39,40 Gambar di bawah memperlihatkan rasio relatif heterodimer Bcl2 dan Bax dalam menentukan kerentanan sel terhadap apoptosis.

Dari gambar di atas tampak bahwa ekspresi berlebihan Bcl2 meningkatkan daya hidup sel, sedangkan ekspresi BAX berlebihan menginduksi apoptosis. Dalam keadaan normal ekspresi BAX dan Bcl2 seimbang.
Mutasi Bcl2 pertama kali diketahui disebabkan translokasi t(14;18) yang berakibat peningkatan fungsi gen bersangkutan. Beberapa penelitian mengungkapkan bahwa ekspresi berlebihan Bcl2 menyebabkan peningkatan daya tahan hidup berbagai jenis sel in vitro dan menghambat apoptosis in vivo. Bcl-X L menunjukkan homologi dengan Bcl2 dan mampu menghambat apoptosis sama efektifnya dengan Bcl2.
Sebagian besar khemoterapi dan radiasi ditujukan untuk menginduksi kematian sel kanker melalui jalur apoptosis. Sebaliknya, resistensi sel kanker terhadap khemoterapi dan atau radiasi sebagian disebabkan terganggunya jalur apoptosis, salah satunya disebabkan ekspresi berlebihan Bcl2 atau Bcl- X L.
Kenyataan ini membuka kemungkinan untuk memberikan terapi kanker dengan mengembalikan fungsi apoptosis melalui pemberian antisense oligonucleotida. Pada percobaan dengan kultur sel kanker metode ini telah berhasil meningkatkan khemosensitifitas.
Segolongan enzim proteolitik yang berperan penting pada apoptosis adalah caspases. Golongan enzim ini disebut demikian karena merupakan cysteine protease yang merombak asam aspartat (c dari cysteine protease, aspase dari merombak protein pada asam aspartat). Banyak sasaran lisis caspase yang disebut death substrate yang diketahui saat ini, antara lain lamin yang merupakan protein penting pada membran nukleus.
Salah satu gambaran apoptosis adalah disorganisasi struktur membran nukleus sehingga lamin termasuk protein penting pada proses apoptosis. Selain bekerja pada nukleus, mesin kematian sel (cell death machinary) juga bekerja di sitoplasma dengan merombak protein-protein substrat yang ada di sitoplasma. Aktivitas caspase berlangsung melalui kaskade yang dalam gambar di bawah diperlihatkan dalam bentuk balok warna gelap.
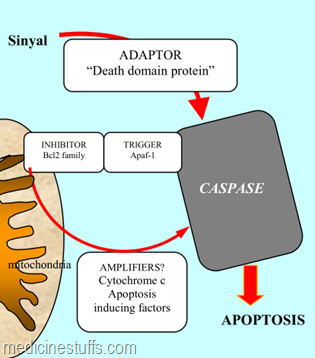
Dalam gambar di atas tampak faktor-faktor yang berpengaruh pada proses apoptosis berupa berbagai protein adaptor, inhibitor dan pemicu (triggers). Ke dalam golongan amplifier termasuk cytochrome c yang ditransportasikan dari mitochondria ke sitoplasma pada saat apoptosis.
Di antara inhibitor apoptosis yang penting, seperti tampak dalam gambar di atas adalah keluarga Bcl2 yang apabila diekspresikan berlebihan akan menghambat translokasi cytochrome-c dari nukleus ke sitoplasma serta mencegah rusaknya membran mitochondria dan dengan demikian mencegah apoptosis.
KESIMPULAN
Kanker berkembang melalui serangkaian perubahan bertahap yang berakhir dengan kehilangan kontrol pertumbuhan yang khas bagi sel kanker, yaitu: proliferasi terus menerus secara tidak terkendali, kemampuan menembus jaringan sekitarnya dan kemampuan metastasis jauh.
Ciri proliferasi abnormal yang khas bagi sel kanker in vivo sama dengan ciri proliferasi sel kanker in vitro, sehingga dengan percobaan-percobaan in vitro dapat dianalisis berbagai sifat biologik kanker termasuk berbagai gen yang mengaturnya. Pada saat ini telah diketahui berbagai sifat pertumbuhan sel kanker termasuk onkogen dan tumor suppressor gene yang terlibat dalam proses transformasi.
Berbagai sifat biologis sel kanker termasuk gangguan dalam proses apoptosis sebagian telah dapat diketahui walaupun belum seluruhnya terungkap. Pengetahuan tentang sifat-sifat sel kanker di tingkat molekuler meningkatkan pengetahuan kita tentang patogenesis kanker dan di kemudian hari dapat digunakan sebagai dasar pemberian terapi yang lebih tepat.
Sel kanker biasanya mengandung jumlah kromosom atau rearrangements kromosom yang abnormal (aneuploidi), yang menunjukkan instabilitas genetik yang berperan penting pada tumorigenesis. Selain itu, sel kanker seringkali berbeda dari sel normal dalam beberapa sifat biokimiawi, termasuk di antaranya peningkatan glikolisis, sekresi faktor pertumbuhan, sekresi protease, penurunan ekspresi protein permukaan yang diperlukan untuk adhesi, dan disorganisasi sitoskeleton.
Seperti telah dikemukakan sebelumnya, beberapa di antara perubahan ini secara langsung berkaitan dengan kelainan sifat pertumbuhan sel yang mengalami transformasi. Misalnya ekskresi faktor pertumbuhan mengurangi kebutuhan sel kanker akan faktor pertumbuhan eksogen, penurunan ekspresi molekul adhesi menyebabkan hilangnya contact inhibition, dan perubahan struktur sitoskeleton menyebabkan morfologi sel ganas berbeda dengan sel normal.
Walaupun demikian tidak ada satupun penanda fenotip ganas di atas unik untuk sel yang mengalami transformasi, demikian pula tidak jelas apakah perubahan-perubahan itu penyebab atau akibat transformasi. Karena itu untuk lebih memahami sifat-sifat sel kanker perhatian diarahkan untuk mempelajari gen-gen spesifik yang diduga menginduksi transformasi.
REGULATOR PERTUMBUHAN SEL
Seperti telah disebut di atas, sel secara terus menerus dihadapkan pada pengambilan keputusan untuk membelah, diferensiasi atau menjalani proses apoptosis. Ketiganya memberi dampak pada jumlah sel sehingga jalur di mana proses pembelahan, diferensiasi dan apoptosis berlangsung merupakan sasaran aktivitas onkogen dan tumor suppressor genes.Golongan gen lain yang juga merupakan sasaran aktivitas onkogenik adalah gen-gen yang berfungsi dalam perbaikan DNA.
Onkogen dan tumor suppressor gene (TSG)
Sebagian besar onkogen dan tumor suppressor gene (TSG) beraksi melalui intervensi langsung pengaturan siklus sel normal. Mutasi proto-onkogen yang menghasilkan amplifikasi dan peningkatan fungsi onkogen (gain of function mutation) mengakibatkan onkogen terus menerus mengaktifkan komponen-komponen lain dalam kaskade transduksi sinyal termasuk faktor transkripsi yang kemudian menghasilkan pembelahan sel.
Di lain fihak mutasi pada TSG yang menyebabkan inaktivasi (loss of function mutation) akan berkibat hilangnya rem pengatur laju pertumbuhan. Beberapa jenis onkogen secara langsung membatalkan aktivitas protektif TSG dan sebaliknya beberapa jenis TSG dapat mendeteksi adanya onkogen dan berusaha melawannya. Kedua kelompok gen ini berinteraksi melalui suatu jejaring pengaturan sinyal pertumbuhan.
Di antara onkogen penting yang berfungsi dalam proses di atas adalah onkogen Ras dan cyclin/cdk Onkogen Ras memegang peranan penting dalam transmisi sinyal ekstraseluler ke dalam sel. Untuk fungsinya ini Ras menggunakan beberapa jalur efektor yang melawan aktivitas berbagai gen supresor (TSG), yaitu jalur Ras-Raf dan jalur Ras-PI3K. Kaskade jalur Ras-Raf-Erk merupakan jalur utama yang bertanggung jawab atas transmisi sinyal proliferasi dari membran sel ke nukleus.
Diduga aktivasi Ras-Raf-Erk ini mengakibatkan peningkatan transkripsi gen MDM2 yang fungsinya menurunkan stabilitas (destabilisasi) gen p53. Peningkatan transkripsi MDM2 menekan aktivitas p53. Selain menekan aktivitas p53, jalur Ras-Raf juga menekan aktivitas gen NF1 yang terlibat dalam perkembangan neurofibromatosis. Dengan menekan fungsi TSG, jalur Ras-Raf-Erk dapat meneruskan sinyal proliferasi kepada gen-gen dalam nukleus yang relevan. pada jalur Ras-PI3K, Ras mengaktifkan phosphatidyl-inositol 3’kinase (PI3K).
Aktivitas PI3K dilawan oleh fosfatase dan keseimbangan antara kedua aktivitas menentukan jumlah fosfatidil-inositol trifosfat pada membran sel. Di antara protein yang diaktifkan dengan cara berikatan dengan fosfatidil- inositol trifosfat adalah serine/threonine kinase Akt. Protein Akt berfungsi melaksanakan proses peningkatan ketahanan hidup yang dipromosikan oleh PI3K.
Beberapa jenis tumor suppressor gene TSG diprogramkan untuk mendeteksi dan berespons terhadap sinyal yang diberikan oleh onkogen, jadi berfungsi sebagai pertahanan terhadap aktivitas onkogen. Beberapa di antaranya adalah p53, BRCA1/BRCA2, NK4a dan ARF. ARF dapat mengikat MDM2 dan menghambat fungsinya; dengan demikian ia menstabilkan p53. ARF dan INK4a diekspresikan sebagai respons terhadap onkogen Ras dan Myc; dengan demikian ia memberi sinyal kepada gen p53 tentang keberadaan onkogen bersangkutan.
Tetapi fungsi gen p53 tidak hanya semata-mata melindungi sel terhadap onkogen; ia juga melindungi sel terhadap kerusakan DNA permanen dengan mendeteksinya dan memberi sinyal kepada gen DNA repair.
Kehilangan atau inaktivasi gen p53 akan berakibat instabilitas genetik. Jumlah protein p53 bertambah sebagai respons terhadap berbagai sinyal, misalnya sinyal kerusakan DNA, terhentinya sintesis DNA atau RNA atau bila tidak tersedia nukleotida (depletion). Rangsangan yang sama juga mengaktifkan p53 tanpa adanya stress, yang biasanya laten.
Peningkatan kecepatan awal translasi mRNA p53 dapat juga mengganggu kestabilan p53. Protein p53 dapat mengalami degradasi melalui berbagai cara, salah satu di antaranya adalah melalui pengikatan dengan protein Mdm2. Gen p53 mutan memiliki half life yang lebih panjang dan produknya tidak mampu meningkatkan ekspresi protein Mdm2 dengan akibat tidak terjadinya degradasi protein p53.
Banyak jalur melalui mana sinyal-sinyal ditangkap oleh p53, di antaranya jalur DNA-dependent protein kinase (DNAPK) yang berfungsi meng-fosforilasi p53, jalur MAP-kinase yang memodulasi p53 dan lain-lain.
P53 berakumulasi dan dimodifikasi serta diaktivasi sebagai respons terhadap sinyal-sinyal yang dihasilkan oleh berbagai stres genotoksik. Beberapa protein, termasuk ATM, PARP (poly-ADP-ribose polimerase), FAS, BLS (Bloom’s syndrome) dan NBS (Nymegen breakage syndrome) terlibat dalam aktivasi. Jalur RAS-MAP kinase terlibat dalam menentukan kadar basal p53 dan dapat mempengaruhi fungsinya.
Beberapa fungsi sel yang dipengaruhi oleh p53 dapat ditekan oleh ekspresi yang tidak terkontrol dari Myc, Bcl2, E1B atau E2F. Kontrol aktivitas p53 mencakup lingkaran autoregulasi yang melibatkan Mdm2. Perangkat lengkap jalur p53 membantu memelihara integritas genom dengan menyingkirkan sel-sel yang rusak, baik dengan menginduksi G1 arrest untuk memperbaiki DNA atau menginduksi apoptosis. Gen p53 juga membantu mengatur masuknya siklus el ke dalam fase mitosis, pembentukan spindle dan integritas sentrosom, yaitu checkpoints siklus sel yang terlibat dalam mencegah kerusakan DNA.
Salah satu jalur yang digunakan oleh p53 untuk menginduksi G1-arrest adalah melalui p21 yang akan melawan aktivitas kompleks cyclin-CDK. Karena itu inaktivasi p21 maupun ekspresi berlebihan cyclin, misalnya cyclin D1 , akan mengakibatkan salah satu jalur regulasi p53 terganggu, dan hal ini sering dijumpai pada berbagai jenis kanker di antaranya kanker kolorektal. Inaktivasi p21 dan atau amplifikasi cyclin berkaitan erat dengan prognosis dan survival.

keterangan : Komponen jalur sinyal p53
Seperti telah diuraikan di atas, mutasi gen p53 dijumpai pada banyak jenis kanker, misalnya pada 75-80% kanker kolon. Individu yang memiliki kerentanan terhadap predisposisi kanker seperti yang terlihat pada sindrom Li-Fraumeni, dilahirkan dengan mewarisi mutasi pada satu alel gen p53 dan dapat menderita kanker dengan mutasi p53 pada kedua alel, walaupun ada juga yang mutasinya terjadi hanya pada satu alel (disebut dominan negatif). Hal ini disebabkan alel p53 yang mutan mengganggu fungsi alel yang normal (wild type). Mutasi p53 seperti telah disebut di atas mengakibatkan instabilitas genetik dan memudahkan terjadinya mutasi gen lain.
Gen BRCA1/BRCA2 adalah tumor suppresor gene yang terdapat dalam berbagai jenis sel dan dikaitkan dengan proliferasi dan diferensiasi sel-sel jaringan yang berasal dari ektoderm dan mesoderm. Dalam jaringan payudara, BRCA1/BRCA2 diekspresikan pada sel epitel alveolar dan duktal. Mutasi BRCA1 dan atau BRCA2 dalam germline cells bertanggung jawab atas sebagian besar kanker payudara herediter.
Protein BRCA1 terletak pada kompartemen nukleus semua sel. Walaupun demikian, distribusinya dalam nukleus bervariasi sesuai siklus sel; ia berkelompok dalam nukleus selama fase S dan G2 dan tersebar merata dalam nukleoplasma pada fase G1.
Lebih dari 200 jenis germline mutations BRCA1 dan lebih dari 80 jenis mutasi BRCA2 telah diidentifikasi yang dapat dijumpai pada keluarga dengan kanker payudara herediter, tetapi peranannya pada kanker payudara sporadis belum diketahui. Walaupun aktivitas biologiknya belum diketahui pasti, bukti-bukti penelitian terakhir mengungkapkan gen tersebut sebagai genome caretakers yang berfungsi memelihara integritas genom.
Tumor suppressor gene lain yang mempunyai peranan penting dalam mengatur pertumbuhan sel adalah gen retinoblastoma (Rb). Seperti telah disebut di atas protein yang secara langsung mengatur atau diatur oleh cyclin-cdk merupakan sasaran lesi pada kanker. Gen Rb adalah salah satu yang telah dipelajari secara intensif di samping gen p53. Gen ini untuk pertama kali dijumpai pada kanker retinoblastoma herediter. Mutasi Rb tidak terbatas pada retinoblastoma tetapi diumpai pada banyak jenis kanker lain. Kelainan fungsi gen Rb disebabkan deletion pada kromosom 13 q14.

keterangan : Deletion pada kromosom 13q14
Seperti tampak pada gambar di atas, kehilangan region pada kromosom 13q14 mengakibat kan mutasi / inaktivasi gen Rb. Protein yang disandi oleh gen Rb, yaitu p105-Rb, diekspresikan dalam nukleus dalam bentuk hiperfosforilasi atau tidak terfosforilasi. Protein p105-Rb yang tidak terfosforilasi terdapat pada sel yang tidak membelah (istirahat) sedangkan yang terfosforilasi terdapat pada sel yang sedang berproliferasi pada fase G1 akhir, sebelum memasuki fase S.
Fosforilasi dan defosforilasi Rb diatur oleh berbagai cyclin, khususnya cyclin-D. Selama fase G1 dari siklus sel, E2F terikat pada p105-Rb yang tidak terfosforilasi tetapi kemudian dilepaskan melalui fosforilasi pada batas fase G1/S. Setelah dilepaskan, E2F mengaktifkan faktor transkripsi yang menjadi sasarannya, di antaranya berbagai enzim yang terlibat dalam sintesis DNA. Kehilangan fungsi atau mutasi Rb, atau adanya DNA virus tumor yang mengikat Rb, menyebabkan gangguan pada proses fosforilasi/defosforilasi Rb yang mengakibatkan gangguan kontrol pertumbuhan.
Telomere dan telomerase
Seperti telah diuraikan di atas, stabilitas genetik merupakan prasyarat untuk pertumbuhan sel normal, sebaliknya instabilitas genetik merupakan salah satu sifat sel kanker yang paling jelas dan banyak sifat sel kanker didasarkan atas instabilitas genetik ini. Stabilitas genetik dapat terganggu melalui berbagai cara, misalnya kegagalan mismatch repair, segregasi kromosom yang tidak tepat, rearrangement kromosom dan kehilangan telomere.
Telomere adalah suatu kompleks antara DNA dengan protein yang menutup dan melindungi ujung-ujung kromosom, sedangkan telomerase adalah enzim protein-RNA yang memperpanjang telomere setiap kali terjadi pembelahan sel. Pada manusia, sel-sel embrio terbukti mengekspresikan telomerase tetapi pada orang dewasa hanya sedikit sel yang memiliki aktivitas telomerase.
Dengan terbatasnya kandungan telomerase, telomere secara bertahap menjadi lebih pendek sejalan dengan bertambahnya umur sel. Erosi ujung kromosom akan membatasi jumlah pembelahan sel. Pada sel kanker, terjadi aktivasi abnormal telomerase yang menyebabkan sel membelah terus. Dengan demikian sinyal untuk menghentikan pertumbuhan diabaikan (by pass) pada tumorigenesis.
Kenyataan ini menimbulkan pemikiran ke arah menghambat aktivitas telomerase sebagai salah satu alternatif terapi. Telomerase di anggap sebagai penanda ganas baru yang merupakan indikator prognosis dan sasaran terapi pada kanker. Setiap kali sel membelah, selalu ada kehilangan 50-100 pasangan basa pada ujung telomer. Hal ini merupakan konsekuensi polaritas untaian DNA dan mekanisme replikasi DNA.
Bila telomere kehilangan sejumlah pasangan basa ia memberikan rangsangan kepada sel untuk menghentikan pembelahan sel. Kehilangan telomere diatasi oleh sel dengan mengaktifkan telomerase yang menambah sekuen telomere untuk mengganti sekuen yang hilang.
Aktivasi telomerase mencegah pemendekan kromosom dan penuaan dengan konsekuensi proliferasi terjadi terus menerus. Struktur telomere di ujung kromosom memendek akibat replikasi DNA. Bila panjang telomere mencapai titik kritis, sebagian besar sel keluar dari siklus sel dan berhenti berproliferasi. Enzim telomerase akan menambah asam- asam amino yang diperlukan untuk membentuk telomere sehingga menambah kemampuan sel untuk membelah.

keterangan : Aktivasi telomerase mencegah pemendekan kromosom
Proses ini berlangsung seimbang, mencegah kromosom memendek selama pembelahan sel dan mencegah sel untuk menerima sinyal penghentian pembelahan sel. Sel yang memproduksi telomerase di antaranya adalah stem-cell dan sel kanker, sedangkan sel somatik normal tidak memiliki aktivitas telomerase.
Stem cell mengurangi produksi telomerase secara bertahap sesuai dengan penuaan sel; kadar telomerase dalam stem cell hanya cukup untuk mencegah kehabisan telomere dalam jaringan yang perlu memperbaharui diri secara cepat.
Apoptosis
Seperti telah disebut di atas salah satu proses yang memberi dampak pada jumlah sel dalam jaringan termasuk jaringan tumor adalah apoptosis. Apoptosis adalah kematian sel terprogram yang merupakan proses penting dalam pengaturan homeostasis normal.
Proses ini menghasilkan keseimbangan dalam jumlah sel jaringan tertentu melalui eliminasi sel yang rusak dan proliferasi fisiologis dan dengan demikian memelihara agar fungsi jaringan normal. Deregulasi apoptosis mengakibatkan keadaan patologis, termasuk proliferasi sel secara tidak terkontrol seperti dijumpai pada kanker.
Ada berbagai bukti yang menyatakan kontrol apoptosis dikaitkan dengan gen yang mengatur berlangsungnya siklus sel, di antaranya gen p53, Rb, Myc, E1A dan keluarga Bcl2. Gangguan regulasi proliferasi sel baik akibat aktivitas onkogen dominan maupun inaktivasi tumor suppressor genes ada hubungannya dengan kontrol apoptosis.
Beberapa jenis virus onkologik melaksanakan proses transformasi sel dengan cara mengganggu fungsi apoptosis dalam sel. misalnya SV40, herpes dan adenovirus, polioma maupun virus Epstein Barr (EBV). Keluarga gen Bcl2 dan produknya diidentifikasi sebagai regulator kunci dalam proses apoptosis dalam banyak jenis sel. Keluarga protein ini dikelompokkan dalam 2 kelompok yaitu kelompok apoptotik dan anti-apoptotik yang berbeda dalam fungsi tetapi mempunyai struktur yang homolog.
Yang termasuk kelompok apoptotik adalah Bax, Bak, Bcl-X S , Bad, Bik dan Bid, sedangkan yang termasuk golongan anti-apoptotik adalah Bcl2, Bcl-X L , Mcl- 1. 39,40 Gambar di bawah memperlihatkan rasio relatif heterodimer Bcl2 dan Bax dalam menentukan kerentanan sel terhadap apoptosis.

keterangan : Kerantanan sel terhadap apoptosis
Dari gambar di atas tampak bahwa ekspresi berlebihan Bcl2 meningkatkan daya hidup sel, sedangkan ekspresi BAX berlebihan menginduksi apoptosis. Dalam keadaan normal ekspresi BAX dan Bcl2 seimbang.
Mutasi Bcl2 pertama kali diketahui disebabkan translokasi t(14;18) yang berakibat peningkatan fungsi gen bersangkutan. Beberapa penelitian mengungkapkan bahwa ekspresi berlebihan Bcl2 menyebabkan peningkatan daya tahan hidup berbagai jenis sel in vitro dan menghambat apoptosis in vivo. Bcl-X L menunjukkan homologi dengan Bcl2 dan mampu menghambat apoptosis sama efektifnya dengan Bcl2.
Sebagian besar khemoterapi dan radiasi ditujukan untuk menginduksi kematian sel kanker melalui jalur apoptosis. Sebaliknya, resistensi sel kanker terhadap khemoterapi dan atau radiasi sebagian disebabkan terganggunya jalur apoptosis, salah satunya disebabkan ekspresi berlebihan Bcl2 atau Bcl- X L.
Kenyataan ini membuka kemungkinan untuk memberikan terapi kanker dengan mengembalikan fungsi apoptosis melalui pemberian antisense oligonucleotida. Pada percobaan dengan kultur sel kanker metode ini telah berhasil meningkatkan khemosensitifitas.
Segolongan enzim proteolitik yang berperan penting pada apoptosis adalah caspases. Golongan enzim ini disebut demikian karena merupakan cysteine protease yang merombak asam aspartat (c dari cysteine protease, aspase dari merombak protein pada asam aspartat). Banyak sasaran lisis caspase yang disebut death substrate yang diketahui saat ini, antara lain lamin yang merupakan protein penting pada membran nukleus.
Salah satu gambaran apoptosis adalah disorganisasi struktur membran nukleus sehingga lamin termasuk protein penting pada proses apoptosis. Selain bekerja pada nukleus, mesin kematian sel (cell death machinary) juga bekerja di sitoplasma dengan merombak protein-protein substrat yang ada di sitoplasma. Aktivitas caspase berlangsung melalui kaskade yang dalam gambar di bawah diperlihatkan dalam bentuk balok warna gelap.

keterangan : Mekanisme apoptosis (kematian sel terprogram secara genetik)
Dalam gambar di atas tampak faktor-faktor yang berpengaruh pada proses apoptosis berupa berbagai protein adaptor, inhibitor dan pemicu (triggers). Ke dalam golongan amplifier termasuk cytochrome c yang ditransportasikan dari mitochondria ke sitoplasma pada saat apoptosis.
Di antara inhibitor apoptosis yang penting, seperti tampak dalam gambar di atas adalah keluarga Bcl2 yang apabila diekspresikan berlebihan akan menghambat translokasi cytochrome-c dari nukleus ke sitoplasma serta mencegah rusaknya membran mitochondria dan dengan demikian mencegah apoptosis.
KESIMPULAN
Kanker berkembang melalui serangkaian perubahan bertahap yang berakhir dengan kehilangan kontrol pertumbuhan yang khas bagi sel kanker, yaitu: proliferasi terus menerus secara tidak terkendali, kemampuan menembus jaringan sekitarnya dan kemampuan metastasis jauh.
Ciri proliferasi abnormal yang khas bagi sel kanker in vivo sama dengan ciri proliferasi sel kanker in vitro, sehingga dengan percobaan-percobaan in vitro dapat dianalisis berbagai sifat biologik kanker termasuk berbagai gen yang mengaturnya. Pada saat ini telah diketahui berbagai sifat pertumbuhan sel kanker termasuk onkogen dan tumor suppressor gene yang terlibat dalam proses transformasi.
Berbagai sifat biologis sel kanker termasuk gangguan dalam proses apoptosis sebagian telah dapat diketahui walaupun belum seluruhnya terungkap. Pengetahuan tentang sifat-sifat sel kanker di tingkat molekuler meningkatkan pengetahuan kita tentang patogenesis kanker dan di kemudian hari dapat digunakan sebagai dasar pemberian terapi yang lebih tepat.
